XÉT NGHIỆM MỚI – HBcrAg THEO DÕI ĐIỀU TRỊ VÀ TIÊN LƯỢNG VIÊM GAN SIÊU VI B
Thạc sĩ bác sĩ Hoàng Thị Thúy Hương
Khoa Huyết học – Truyền máu
I. Viêm gan siêu vi B
- Dịch tễ học nhiễm virus viêm gan B
Nhiễm Hepatitis B virus (HBV) là một vấn đề sức khỏe nghiêm trọng trên toàn cầu. Theo Báo cáo Toàn cầu về Viêm gan vi rút 2017 của Tổ chức Y tế Thể giới, ước tính năm 2015 toàn cầu có khoảng 257 triệu người nhiễm HBV mạn và 884.400 người tử vong, phần lớn do các biến chứng xơ gan và ung thư biểu mô tế bào gan (HCC). HBV lây nhiễm qua đường máu, quan hệ tình dục và từ mẹ sang con. Việt Nam nằm trong vùng dịch tễ lưu hành cao của nhiễm HBV (tỉ lệ nhiễm HBV > 8%) với đường lây chủ yếu là từ mẹ truyền sang con.
Khoảng 8 – 20% bệnh nhân VGBM người lớn tiến triển đến XG trong vòng 5 năm nếu không được điều trị. Trong số này có 20% xuất hiện mất bù gan và 2 – 5% bị ung thư tế bào gan (UTTBG) hàng năm. Trên toàn cầu, ước tính khoảng 30% trường hợp XG và 45% trường hợp HCC do HBV. Có khoảng 1 triệu trường hợp HCC được chẩn đoán mỗi năm và đa số liên quan đến nhiễm HBV.
2. Cấu trúc virus viêm gan B
Virus viêm gan B (HBV) thuộc họ Hepadnaviridae và giống Orthohepadnavirus, là virus hướng gan có cấu trúc DNA với khả năng chịu đựng nhiệt độ và độ ẩm khắc nghiệt.
HBV hoàn chỉnh (virion) là 1 tiểu thể hình cầu có đường kính khoảng 42 nm, được gọi là là tiểu thể Dane, bao gồm một lớp vỏ ngoài (HBsAg) bao bọc xung quanh một lõi nucleocapsid bên trong (Hình 1.A). Lớp vỏ được cấu tạo bởi một lớp lipid kép và 3 protein bề mặt có kích thước nhỏ (SHBs), trung bình (MHBs) và lớn (LHBs). Phần lõi (core particle) có kích thước 27 nm gồm có protein lõi (HBcAg), chuỗi DNA mạch kép không hoàn chỉnh và một số enzyme quan trọng như DNA polymerase, protein kinase.
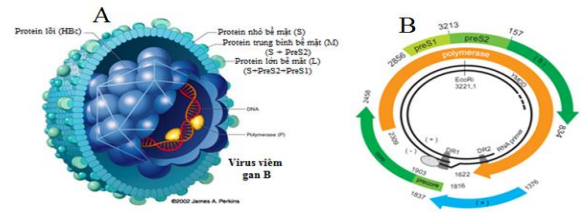
Hình 1. Cấu trúc tiểu thể virus (A), bộ gen của HBV (B).
Bộ gen của HBV gồm một cặp DNA có chiều dài 3,2 kilobase, trọng lượng phân tử 2 x 106 dalton, có cấu trúc 2 chuỗi đơn và có chiều dài khác nhau.
– Chuỗi dài (chuỗi âm): nằm ngoài, tạo nên một vòng tròn liên tục có chiều dài cố định là 3,2 kb mang toàn bộ thông tin di truyền của HBV.
– Chuỗi ngắn (chuỗi dương): nằm trong, có kích thước thay đổi và chỉ chiếm khoảng 50 – 80% chuỗi dài của bộ gen.
Bộ gen của HBV chứa 4 khung đọc mở xếp chồng lên nhau tương ứng với các gen S (pre-S/S), P, X và C (pre-C/C) mã hóa 4 nhóm protein khác nhau lần lượt là (LHBs, MHBs, SHBs), polymerase, HBxAg và (HBeAg, HBcAg). Cấu trúc chồng chéo của các vùng mã hóa tạo điều kiện cho việc sử dụng bộ gen HBV với hiệu suất lên đến 150%.
Có 10 kiểu gen khác nhau của HBV (A – J), dựa trên sự đa dạng về di truyền do sự khác nhau trong trình tự chuỗi nucleotide của hệ gen. Sự khác nhau này lần lượt là 8% đối với các kiểu gen và 4 – 8% đối với dưới kiểu gen.
II. HBcrAg – Dấu ấn sinh học mới theo dõi và tiên lượng viêm gan siêu vi B
1. Tính cấp thiết của việc theo dõi và tiên lượng viêm gan siêu vi B
HBV không thể dễ dàng bị đào thải khỏi gan, bởi vì cccDNA, phần tử chủ chốt chịu trách nhiệm sự tồn tại của virus. cccDNA là mẫu phiên mã ổn định, ngoài mẫu sao chép nhiễm sắc thể cho tất cả các mRNA HBV như pRNA tiền gen, số lượng và hoạt động phiên mã của cccDNA trong tế bào gan rất quan trọng đối với tiến triển CHB và kết quả lâm sàng. Thật không may, mặc dù các chất tương tự nucleos (t) ide (NA) hoặc interferon (IFN) có thể ngăn chặn hiệu quả sự sao chép của HBV, nhưng đây không phải là phương pháp điều trị hết bệnh. Những thuốc này không nhắm trực tiếp vào cccDNA. Do đó, mục tiêu hiện tại để kiểm soát HBV là đạt được mức độ ức chế virus học cao, tốt nhất là với sự thanh thải huyết thanh kháng nguyên bề mặt viêm gan B (HBsAg), dẫn đến thuyên giảm sinh hóa, mô học cải thiện và giảm nguy cơ biến chứng.
Mặc dù sinh thiết gan là kỹ thuật chính xác nhất để định lượng cccDNA và HBV DNA trong gan, nhưng nó bị hạn chế vì tính năng xâm lấn của nó. Do đó, các dấu ấn sinh học huyết thanh học không xâm lấn được mong đợi sẽ được sử dụng làm dấu hiệu thay thế cho hoạt động nhân bản của virus trong gan. Với những phát triển gần đây trong sinh học phân tử, một số dấu ấn sinh học liên quan đến diễn tiến tự nhiên của viêm gan B mạn (CHB) và hiệu quả của liệu pháp kháng virus đã được xác định. Các dấu ấn sinh học huyết thanh học thông thường bao gồm nồng độ HBV DNA trong huyết thanh và hiệu giá HBsAg, cả hai đều dự đoán nguy cơ xơ gan và HCC. Tuy nhiên, xơ gan và ung thư biểu mô tế bào gan vẫn có thể xảy ra ở những bệnh nhân có HBV DNA không phát hiện được và thanh thải HBsAg trong huyết thanh. Ngoài ra, để dự đoán chuyển đổi huyết thanh HBeAg tự phát hoặc do điều trị, cần có thông tin cần thiết bao gồm các đáp ứng dai dẳng trước và sau khi ngừng sử dụng các chất tương tự nucleos (t), khả năng tái hoạt động của HBV và sự tái nhiễm HBV sau khi ghép gan để cải thiện kết quả của bệnh nhân, do đó, các dấu ấn sinh học mới và hiệu quả vẫn được yêu cầu.
HbcrAg là dấu ấn sinh học hiệu quả mới, có nhiều tính năng độc đáo: tiên đoán đáp ứng điều trị, khả năng dự đoán HCC và nhiều ứng dụng trong quản lý viêm gan B mạn.
2. Thành phần cấu tạo của HBerAg
HBcrAg chứa ba sản phẩm được mã hóa bởi gen preore / core. HBe Ag là một peptide tuần hoàn có nguồn gốc từ protein trước khi phân giải protein và được tiết ra từ tế bào gan. HBcAg là một thành phần của virion và tạo thành nucleocapsid bao quanh DNA của virus. p22cr là một tiền protein 22 kDa có trong hạt tử Dane rỗng âm tính với HBV DNA. Tất cả ba protein đều có chung một chuỗi 149 axit amin . HBcAg, p22cr và HBeAg đều có thể được đo là HBcrAg bằng xét nghiệm huyết thanh học.
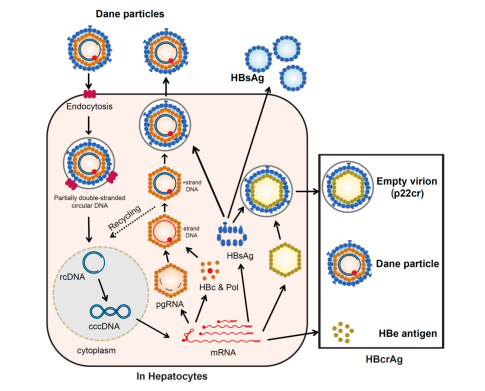
Hình 2. Vòng đời virus viêm gan B và HBcrAg. Nguồn gốc các phân tử HBV ứng dụng trong lâm sàng dùng chẩn đoán, theo dõi, tiên lượng bệnh.
3. Ứng dụng dấu ấn sinh học HBcrAg trong lâm sàng
Dấu ấn sinh học mới, HBcrAg, đã được sử dụng để hỗ trợ theo dõi CHB và dự đoán kết quả lâm sàng. Trong phần này mô tả ngắn gọn các ứng dụng lâm sàng của HBcrAg, đã được báo cáo gần đây trên khắp thế giới. Ứng dụng lâm sàng của HBcrAg ở bệnh nhân CHB được tóm tắt trong bảng 1:
| Phân loại | Tình hình bệnh | Nồng độ HBcrAg (log U/mL) |
| Diễn tiến tự nhiên | Chuyển đổi huyết thanh HBeAg | <4,92 log |
| Chuyển đổi huyết thanh HBsAg | Âm tính , (2,7 log) | |
| Hoạt động cccDNA | cccDNA trong gan thấp hoặc không hoạt động | <3log |
| Phản ảnh virus không hoạt động với độ tin cậy cao | ≤ 3log và HBV DNA ≤ 2000 U/mL | |
| Điều trị kháng virus | Chuyển đổi huyết thanh HBeAg khi dùng PegIFN tuần 12 | Không đáp ứng khi ban đầu HBcrAg>8log |
| Chuyển đổi huyết thanh HBeAg khi dùng PegIFN + NA 4 tuần và tiếp tục PegIFN 20 tuần | Không đáp ứng khi ban đầu HBcrAg>4,5 log | |
| Không kháng Lamivudine | <4,6log sau 6 tháng điều trị | |
| Tái phát trong vòng 1 năm sau khi ngưng NA | HBcrAg> 3,7 log lúc dừng | |
| Tái phát bất kể HBV DNA âm tính hơn 6 tháng | 3,2—3,7 log khi ngừng NA | |
| HCC xảy ra hay tái phát | Nguy cơ cao khi HBV DNA trung bình ( 2.000- 19.900 U/mL) | ≥ 4log |
| Tích lũy HCC trong khi điều tri NA | ≥3,4 log ở thời điểm HBV DNA âm tính | |
| Phát triển HCC trong khi điều tri NA | Phát hiện HBcrAg | |
| Hiệu quả lâu dài của NA đối với HCC | HBcrAg cao và đột biến BCP liên quan HCC, độc lập với NA | |
| Đánh giá tái phát HCC | HBcrAg>3log và HBsAg>3log | |
| Tỉ lệ HCC đối với BN đã điều trị | >4,67log trước điều trị và > 3,89 log sau điều trị | |
| Phát triển HCC BN chưa điều trị | >2,9log | |
| HCC tái phát trong vòng 2 năm | >4,8 log lúc chẩn đoán | |
| Tái phát HBV | Tái phát HBV khi dùng ức chế miễn dịch 2 năm | Phát hiện HBcrAg lúc ban đầu |
| Tái nhiễm HBV | cccDNA cao sau ghép gan | >4 log trước khi ghép gan |
Bảng 1: Ứng dụng HBcrAg trên bệnh nhân nhiễm virus viêm gan B mạn
3.1 Ứng dụng theo dõi điều trị:
Nồng độ HBcrAg huyết thanh có liên quan chặt chẽ với nồng độ cccDNA trong gan, cũng như HBV DNA huyết thanh. Do đó, nồng độ HBcrAg trong huyết thanh tương quan với các dấu hiệu sao chép của HBV. Từ Pháp, Testoni và cộng sự. gần đây đã xác nhận rằng nồng độ HBcrAg trong huyết thanh ở bệnh nhân dương tính với HBeAg cao hơn đáng kể so với nồng độ ở bệnh nhân âm tính với HBeAg mà không điều trị bằng thuốc kháng vi-rút. Họ cũng mô tả rằng huyết thanh HBcrAg tương quan với nồng độ HBV DNA huyết thanh, pgRNA trong gan và cccDNA cũng như hoạt động phiên mã. Ở bệnh nhân CHB, kết quả âm tính đối với HBcrAg (<3 log U/mL) có nghĩa là lượng cccDNA trong gan thấp hơn và hoạt động của cccDNA thấp hơn so với bệnh nhân dương tính với HBcrAg. Riveiro-Barciela và cộng sự. ở Tây Ban Nha báo cáo rằng nồng độ HBsAg <3 log IU/mL chỉ hữu ích trong việc xác định người mang gen không hoạt động kiểu gen D. Một phép đo HBcrAg duy nhất 3 log U/mL cộng với HBV DNA 2000 IU/mL có độ chính xác cao trong việc xác định người mang mầm bệnh không hoạt động, bất kể kiểu gen HBV của họ.
3.2 Dự báo sự xuất hiện của Ung thư biểu mô tế bàn gan (HCC)
Rất khó để dự đoán bệnh nhân nào sẽ phát triển bệnh gan tiến triển, bao gồm cả HCC, trong quá trình điều trị NA. Hiệu giá DNA HBV cao có liên quan đến việc tăng nguy cơ xơ gan và phát triển HCC. Tải lượng virus HBV thấp hoặc không thể phát hiện được sẽ làm giảm nguy cơ phát triển HCC nhưng không ức chế hoàn toàn. Một số dấu hiệu HBV đã được chứng minh là có liên quan đến sự phát triển HCC ở bệnh nhân CHB, bao gồm cả nồng độ HBcrAg huyết thanh.
Trong một nghiên cứu đoàn hệ lớn, HBcrAg vượt trội hơn HBV DNA về khả năng dự đoán sự phát triển HCC ở bệnh nhân CHB chưa từng điều trị. Trong thời gian theo dõi (trung bình, 10,7 năm), 78 trong số 1031 (7,6%) bệnh nhân CHB không điều trị NA đã phát triển HCC. Sử dụng nồng độ HBcrAg, nồng độ HBV DNA, trạng thái HBeAg, các đồng biến số của trạng thái kiểu gen HBV và trạng thái kích thích lõi cơ bản (BCP), mô hình nguy cơ theo tỷ lệ Cox cho thấy các đột biến HBcrAg > 2,9 log U/mL và BCP có liên quan độc lập với sự xuất hiện HCC. Trong khi đó, Tseng et al. Mô tả rằng nồng độ HBcrAg là yếu tố nguy cơ độc lập của HCC ở bệnh nhân CHB có tải lượng virus trung bình (HBV DNA từ 2000 đến 19.999 IU/mL). Mức HBcrAg 4,0 log U/mL xác định những bệnh nhân có tải lượng virus trung bình có nguy cơ cao mắc HCC.
Đối với những bệnh nhân đã từng điều trị, NA giảm nhưng không thể loại trừ nguy cơ xuất hiện HCC. HBcrAg trong số 109 bệnh nhân CHB được điều trị NA trong ít nhất hai năm là yếu tố nguy cơ độc lập đối với sự phát triển HCC (HR, 3,53) . Ở 76 bệnh nhân CHB được điều trị NA với HBV DNA huyết thanh không thể phát hiện được, nồng độ HBcrAg lúc ban đầu (trước điều trị) cũng cao hơn đáng kể ở những bệnh nhân phát triển HCC (5,45 log U/mL) so với nhóm bệnh nhân đối chứng phù hợp (4,55 log U). /mL) (p = 0,005). Ngoài ra, điều trị trước, HBcrAg > 4,67 log U/mL, dự đoán tỷ lệ mắc ung thư biểu mô tế bào gan một cách độc lập. Hơn nữa, sau điều trị, HBcrAg > 3,89 log U/mL, dự đoán ung thư biểu mô tế bào gan với tỷ số chênh là 3,27. Chỉ xem xét những bệnh nhân không xơ gan, ngưỡng >3,90 log U/mL dự đoán HCC với tỷ lệ chênh lệch là 5,95.
Hiệu quả liên tục của điều trị NA đối với sự phát triển HCC đã được nghiên cứu bởi Kumada et al. Bệnh nhân CHB được điều trị NA được so sánh với những người không điều trị. Có 57/234 bệnh nhân (24,4%), HCC phát triển trong thời gian theo dõi. Họ đã chứng minh rằng tuổi lớn hơn (HR 4,36 [KTC 95%, 1,33–14,29], p = 0,015), điều trị NA (HR 0,28 [0,13–0,62], p = 0,002), đột biến BCP (HR 12,74 [1,74–93,11], p = 0,012), HBcrAg cao (HR 2,77 [1,07–7,17], p = 0,036) và nồng độ gamma glutamyl transpeptidase cao (HR 2,76 [1,49–5,12], p = 0,001) là những yếu tố liên quan đáng kể đến sự phát triển HCC. Họ kết luận rằng nồng độ HBcrAg và đột biến BCP cao hơn có liên quan đến sự phát triển HCC, độc lập với liệu pháp NA.
Hiệu quả liên tục của điều trị NA đối với sự phát triển HCC đã được nghiên cứu bởi Kumada et al. Bệnh nhân CHB được điều trị NA được so sánh với những người không điều trị. Có 57/234 bệnh nhân (24,4%), HCC phát triển trong thời gian theo dõi. Họ đã chứng minh rằng tuổi lớn hơn (HR 4,36 [KTC 95%, 1,33–14,29], p = 0,015), điều trị NA (HR 0,28 [0,13–0,62], p = 0,002), đột biến BCP (HR 12,74 [1,74–93,11], p = 0,012), HBcrAg cao (HR 2,77 [1,07–7,17], p = 0,036) và nồng độ gamma glutamyl transpeptidase cao (HR 2,76 [1,49–5,12], p = 0,001) là những yếu tố liên quan đáng kể đến sự phát triển HCC. Họ kết luận rằng nồng độ HBcrAg và đột biến vùng Basal core promoter (BCP) cao hơn có liên quan đến sự phát triển HCC, độc lập với liệu pháp NA. Để đánh giá sự xuất hiện HCC ở bệnh nhân CHB, sự kết hợp các giá trị HBsAg và HBcrAg là một dấu ấn sinh học hiệu quả. Trong một nghiên cứu gần đây, 449 bệnh nhân viêm gan B liên tiếp đã được ghi danh và mối liên quan giữa HBsAg và HBcrAg với sự xuất hiện HCC đã được kiểm tra. Nếu giá trị ngưỡng của HBsAg và HBcrAg lần lượt là 3,0 và 3,0 log U/mL thì bệnh nhân CHB có biểu hiện HCC thường nằm trong nhóm HBsAg thấp ( p = 0,002) và nhóm HBcrAg cao (p < 0,001). Khi kết hợp HBsAg và HBcrAg, sự xuất hiện HCC thường gặp nhất ở phân nhóm có HBsAg thấp và HBcrAg cao, trong số những bệnh nhân âm tính với HBeAg, bất kể liệu pháp NA. Trong 338 bệnh nhân không xuất hiện HCC khi tuyển chọn, HCC phát triển thường xuyên hơn đáng kể ở nhóm HBsAg thấp/HBcrAg cao (p = 0,005) trong một phân tích dọc.
3.3 Yếu tố dự báo HCC sau phẫu thuật:
Để dự đoán tái phát HCC sau khi cắt bỏ, các dấu ấn sinh học huyết thanh học cũng đã được sử dụng. Tuy nhiên, tỷ lệ tái phát HCC sau phẫu thuật vẫn cao bất kể điều trị NA. Trong một báo cáo gần đây, tỷ lệ tái phát HCC lên tới 41,8% trong hai năm. Ngoài kích thước khối u, số lượng khối u, sự xâm lấn mạch máu lớn và xơ gan, nồng độ HBsAg huyết thanh trước phẫu thuật >1000 IU/mL, HBeAg dương tính ban đầu và việc kê đơn các NA khác ngoài entecavir hoặc tenofovir đều có liên quan đến tỷ lệ tái phát HCC cao hơn.
Một nghiên cứu hiện tại cũng xác nhận rằng HBcrAg cho thấy giá trị tiên đoán tái phát HCC sau khi điều trị bằng phẫu thuật chữa bệnh. Trong một nghiên cứu trên 55 bệnh nhân CHB được phẫu thuật chữa khỏi HCC, nồng độ HBcrAg huyết thanh > 4,8 log U/mL tại thời điểm chẩn đoán HCC cho tỷ lệ HR cao (8,96) đối với tái phát HCC sau đó trong vòng hai năm. Trong một nghiên cứu khác, trong số 21 bệnh nhân HCC được ghép gan, 5 bệnh nhân (2 trong số 14 bệnh nhân HBcrAg dương tính và 3 trong số 7 bệnh nhân HBcrAg âm tính) đã phát triển tái phát HCC sau ghép gan. Ngược lại, sự dương tính của HBcrAg sau ghép gan không tương quan với sự tái phát HCC. Nghĩa là, nồng độ HBcrAg huyết thanh trước khi phẫu thuật chữa bệnh có thể là một chỉ số có thể xảy ra để phân tầng các chiến lược quan sát sau phẫu thuật và tìm ra những bệnh nhân CHB có nguy cơ tái phát HCC cao.
Hơn nữa, trong một báo cáo gần đây, tỷ lệ sống sót không tái phát HCC thấp hơn đáng kể ở những bệnh nhân HCC có cccDNA trong gan và nồng độ HBcrAg huyết thanh cao so với những bệnh nhân có cccDNA thấp (p = 0,035) và nồng độ HBcrAg thấp (P = 0,003).
III. Kết luận
- Nhiễm HBV là một vấn đến sức khỏe nghiêm trọng toàn cầu. Vì vậy việc phát hiện, theo dõi và điều trị viêm gan virus siêu vi B là một vấn đề rất quan trọng đối với bệnh nhân.
- Các xét nghiệm kinh điển như HBV DNA, HbsAg, HbeAg… đã thể hiện được vai trò to lớn trong việc chẩn đoán, theo dõi và điều trị bệnh viêm gan virus siêu vi B. Với sự xuất hiện của dấn ấn sinh học HBcrAg đã khỏa lấp khoảng trống thiếu sót của các xét nghiệm kinh điển trên.
- HBcrAg – Dấu ấn sinh học mới có tính năng nổi bật: tiên đoán đáp ứng điều trị, khả năng dự đoán HCC và nhiều ứng dụng trong quản lý viêm gan B mạn.
TÀI LIỆU THAM KHẢO
- Phạm Thị Thu Thủy, Giá trị của HBcrAg trong chẩn đoán – theo dõi và tiên lượng viêm gan siêu vi B, http://vasld.com.vn/gia-tri-cua-hbcrag-trong-chan-doan-theo-doi-va-tien-luong-viem-gan-sieu-vi-b.
- Nguyen VTT (2012), “Hepatitis B infection in Vietnam: Current Issues and Future Challenges”, Asia-Pacific Journal of Public Health, 24(2), pp.361 – 373.
- El-Serag HB. Epidemiology of viral hepatitis and hepatocellular carcinoma. Gastroenterology. 2012;142(6):1264-1273. e1
- World Health Organization (2015), “Guidelines for the prevention, care and treatment of persons with chronic hepatitis B infection”, pp. 1 – 166.
- Inan N, Tabak F (2015), “Hepatitis B Virus: Biology and life cycle”, Viral Hepatitis Journal, 21(1), pp. 1-7.
- Kao JH (2011), “Molecular Epidemiology of Hepatitis B Virus”, Korean J Intern Med, 26, pp. 255 – 261.
- Inoue T., Tanaka Y. The Role of Hepatitis B Core-Related Antigen. 2019;10:357. doi: 10.3390/genes10050357.
- Testoni B., Lebosse F., Scholtes C., Berby F., Miaglia C., Subic M., Loglio A., Facchetti F., Lampertico P., Levrero M., et al. Serum hepatitis B core-related antigen (HBcrAg) correlates with covalently closed circular DNA transcriptional activity in chronic hepatitis B patients. Hepatol. 2018 doi: 10.1016/j.jhep.2018.11.030.
- Liu Y.Y., Liang X.S. Progression and status of antiviral monitoring in patients with chronic hepatitis B: From HBsAg to HBV RNA. World J. Hepatol. 2018;10:603–611. doi: 10.4254/wjh.v10.i9.603.
- Tada T., Kumada T., Toyoda H., Kiriyama S., Tanikawa M., Hisanaga Y., Kanamori A., Kitabatake S., Yama T., Tanaka J. HBcrAg predicts hepatocellular carcinoma development: An analysis using time-dependent receiver operating characteristics. Hepatol. 2016;65:48–56.
- Tseng T.C., Liu C.J., Hsu C.Y., Hong C.M., Su T.H., Yang W.T., Chen C.L., Yang H.C., Huang Y.T., Fang-Tzu Kuo S., et al. High Level of Hepatitis B Core-Related Antigen Associated With Increased Risk of Hepatocellular Carcinoma in Patients With Chronic HBV Infection of Intermediate Viral Load. 2019;157:1518–1529. doi: 10.1053/j.gastro.2019.08.028.