PHỐI HỢP DẤU ẤN UNG THƯ LÀM TĂNG KHẢ NĂNG PHÁT HIỆN UNG THƯ BIỂU MÔ TẾ BÀO GAN GIAI ĐOẠN SỚM
Thạc sĩ bác sĩ Hoàng Thị Thúy Hương
Khoa Huyết học – Truyền máu
- Ung thư biểu mô tế bào gan (HCC – UTBMTBG)
Ung thư biểu mô tế bào gan (hepatocellular carcinoma: HCC – UTBMTBG) là bệnh ác tính, cùng với tỷ lệ tử vong cao và số người mắc mới hàng năm ngày càng tăng, đặc biệt ở các quốc gia đang phát triển. Theo GLOBOCAN 2020, Việt Nam có thêm 26.418 người mắc ung thư gan và 25.272 người tử vong vì ung thư gan. Ung thư gan lại là ung thư đứng hàng đầu trong các ung thư mới mắc ở cả 2 giới tại Việt Nam năm 2020 theo Globocan; Tỉ lệ ung thư gan mới ở nam là 20,5% và ở nữ là 7,4%. Do đó để kiểm soát tốt ung thư gan như giảm tỉ lệ bệnh nhân HCC, chẩn đoán và điều trị HCC kịp thời thì chúng ta phải kiểm soát tốt các yếu tố nguy cơ của HCC, quan tâm đến HCC và tầm soát chẩn đoán HCC càng sớm càng tốt để đạt được kết quả điều trị HCC tốt nhất.
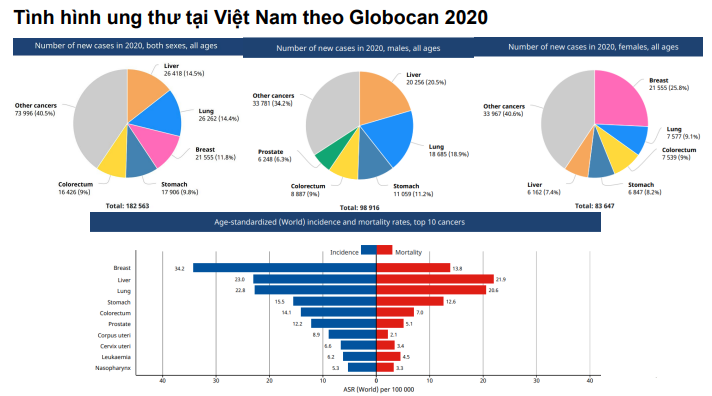
Hình 1: Tình hình mắc các loại ung thư ở Việt Nam theo GLOBOCAN 2020
2. Phối hợp các dấu ấn ung thư trong phát hiện và điều trị sớm HCC:
2.1 Các chỉ dấu ung thư gan trong xét nghiệm máu:
Chỉ dấu ung thư – dấu ấn u (tumour markers) được định nghĩa là một phân tử, một chất, hoặc một quá trình có thể phát hiện được khi có sự biến đổi so với bình thường trong các bệnh lí liên quan đến u tân sinh. Các dấu ấn này có thể tìm thấy trong tế bào, trong mô hoặc trong dịch cơ thể. Sự thay đổi này có thể là thay đổi về nồng độ, thay đổi về mặt cấu trúc hoặc thay đổi ở vị trí sản xuất các phân tử. Một dấu ấn u được coi là lí tưởng khi dấu ấn đó phân biệt rạch rồi giữa người bình thường và người bệnh, chỉ được sản xuất bởi mô ác tính, đặc hiệu cho vị trí ung thư, nồng độ tỉ lệ với kích thước khối u (Dấu ấn u có độ nhạy 100% và độ đặc hiệu 100%).
Nhưng thực tế không có dấu ấn ung thư nào có thể phân biệt hoàn toàn giữa người khỏe mạnh, người bệnh lành tính và người mắc ung thư. Vì vậy nhiệm vụ của chúng ta là phải tìm điểm cắt tối ưu nhất để làm tăng độ nhạy và độ đặc hiệu của dấu ấn ung thư.

Hình 2. Tìm âm tính giả và dương tính giả là một nhiệm vụ của điểm cắt
2.1.1 AFP (α-fetoprotein):
– Là một glycoprotein thuộc nhóm protein kháng nguyên phôi thai (oncofetal protein). Protein kháng nguyên phôi thai là những protein được sản xuất trong thời kì phát triển của phôi thai và hầu như không thấy ở mô hay tế bào người lớn trưởng thành. AFP được sản xuất ở túi noãn hoàng, tế bào biểu mô ống tiêu hóa, gan trong thời kì phát triển bào thai. Ở người lớn không mang thai, AFP tồn tại với nồng độ rất thấp. Ở người lớn, nồng độ AFP tăng gặp trong tình trạng tái tạo tế bào gan (như trong viêm gan mạn hay xơ gan), ung thư hóa tế bào gan (như trong HCC hay trong u nguyên bào gan), carcinome phôi (hay u tế bào mầm loại không tinh bào), phụ nữ có thai.
– Trong các dấu ấn ung thư biểu mô tế bào gan, AFP là dấu ấn được áp dụng đầu tiên và cho đến nay vẫn được nghiên cứu rộng rãi và chi tiết nhất. Trong HCC, AFP có thể được dùng trong tầm soát, chẩn đoán, theo dõi điều trị và tiên lượng cho bệnh nhân. Bộ Y tế khuyến cáo tầm soát HCC bằng xét nghiệm AFP kết hợp với siêu âm bụng theo Quyết định số 3129/QĐ-BYT ban hành ngày17 tháng 7 năm 2020 về Hướng dẫn chẩn đoán và điều trị ung thư biểu mô tế bào gan.
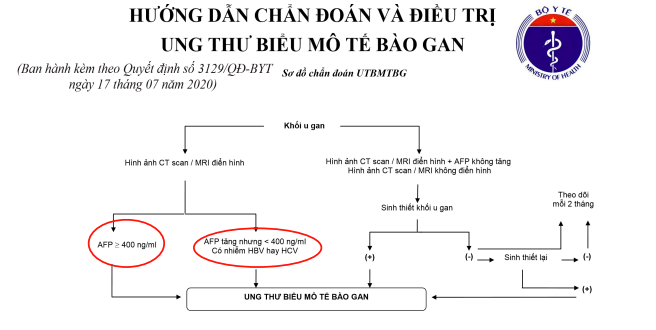
Hình 3. Quyết định số 3129/QĐ-BYT ngày 17 tháng 07 năm 2020
Tuy nhiên việc sử dụng AFP trong tầm soát HCC giai đoạn sớm còn những hạn chế nhất định. Theo APASL Guidelines for HCC – 2017 thì:
| Ngưỡng cắt | Độ nhạy | Độ đặc hiệu |
| 20 ng/mL | 49 – 71% | 49 – 71% |
| 200 ng/mL | 4 – 31 % | 76 – 100 % |
Theo nghiên cứu của Federico Piñero cùng các cộng sự thì độ nhạy và độ đặc hiệu của AFP như sau:
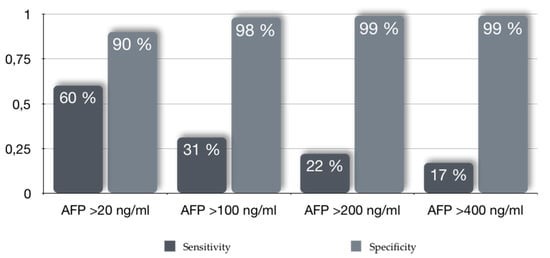
Hình 4. Độ nhạy và độ đặc hiệu theo giá trị ngưỡng alpha-fetoprotein (AFP) trong chẩn đoán ung thư biểu mô tế bào gan (HCC) sớm.
Qua một số nghiên cứu, nồng độ AFP không đạt hiệu quả cao trong tầm soát HCC giai đoạn sớm. Hơn nữa nồng độ AFP ở bệnh nhân xơ gan dao động phản ánh đợt cấp của nhiễm siêu vi viêm gan B (HBV) hoặc siêu vi viêm gan C (HCV), đợt bùng phát bệnh gan mạn hoặc HCC tiến triển. Và chỉ một tỉ lệ nhỏ HCC ở giai đoạn sớm (10-20%) biểu hiện bất thường nồng độ AFP trong huyết thanh, không phải tất cả các tế bào u đều bài tiết AFP. Vì những lí do kể trên, AFP không được dùng đơn độc trong sử dụng với mục đích chẩn đoán HCC mà phải kết hợp với các phương tiện khác như hình ảnh học, hoặc các dấu ấn u khác.
2.1.2. DCP (Des-gamma-carboxy prothrombin) – PIVKA II
(prothrombin induced by vitamin K absence-II, prothrombin gây ra bởi sự thiếu hụt vitamin K-II), hay còn được gọi là DCP (Des-γ-carboxyprothrombin) là một prothrombin tăng bất thường ở bệnh nhân HCC. Trong chu trình sinh hóa bình thường, tiền chất prothrombin được carboxyl hóa sau chuyển mã nhờ enzyme carboxylase phụ thuộc vitamin K trong gan. Giảm nồng độ γ-carboxylase dẫn đến tăng tổng hợp PIVKA II. Tăng mức PIVKA II trong máu là hậu quả của việc thiếu hụt vitamin K hoặc do sử dụng thuốc kháng vitamin K, do đó PIVKA II có thể tăng giả ở các bệnh nhân này dù không có HCC. Trong HCC, sự chuyển hóa này bị cản trở do sự ức chế enzyme carboxylase sau dịch mã (posttranslation) do rối loạn trong gene dẫn đến tích lũy DCP mà không phụ thuộc vào sự thiếu hụt vitamin K. Bên cạnh đó một giả thuyết khác là vitamin K ức chế sự phát triển u trong môi trường in vitro, do đó sự sản xuất PIVKA II phản ứng sự khiếm khuyết trong con đường ức thế u thông qua vitamin K.
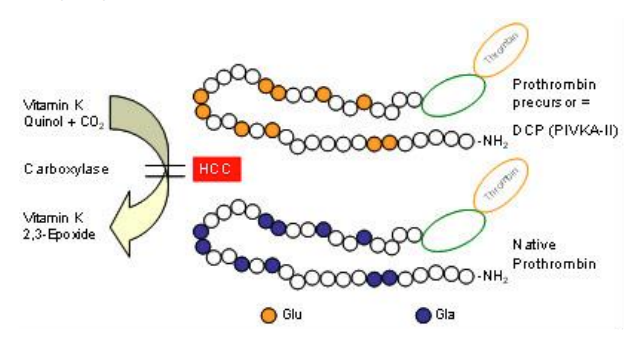
Hình 5. Quá trình tạo thành DCP
Theo nghiên cứu của Chan HLY cùng các cộng sự năm 2020 thì tại điểm cắt 28,4 ng / ml PIVKA-II cho thấy độ nhạy cao kết hợp với độ đặc hiệu cao trong phát hiện HCC:

Hình 7. Đánh giá hiệu năng của DCP trong HCC
2.1.3 Phối hợp AFP và DCP trong phát hiện HCC giai đoạn sớm:
Theo một nghiên cứu của Ricco G và các cộng sự năm 2018, việc phối hợp dấu ấn AFP và DCP sẽ tăng khả năng phát hiện HCC đối với các bệnh nhân viêm gan virus B/C mạn, viêm gan không do virus, viêm gan do rượu và không do rượu. Thay vì sử dụng một dấu ấn riêng lẻ.
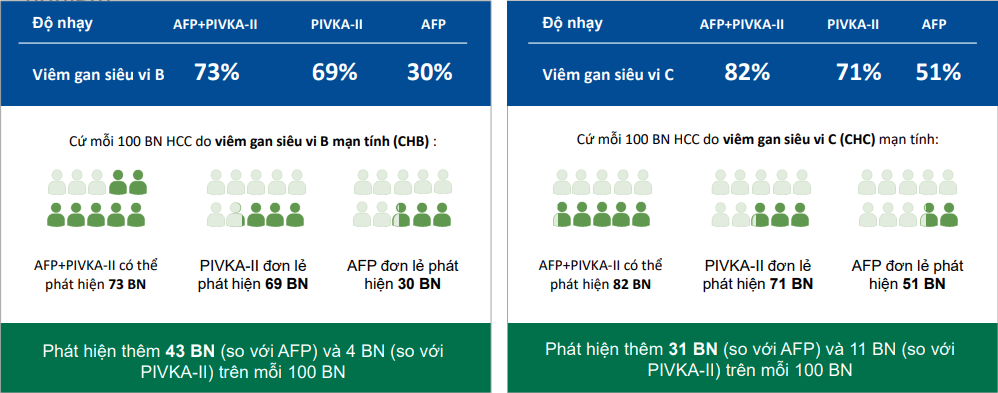
Hình 7. Hiệu năng phối hợp dấu ấn AFP và DCP phát hiện HCC trong viêm gan virus B/C mạn.

Hình 8. Hiệu năng phối hợp dấu ấn AFP và DCP phát hiện HCC trong viêm gan không do virus, do rượu và không do rượu.
Theo một nghiên cứu của Henry Ly Chan cùng các đồng sự thì việc phối hợp dấu ấn AFP và DCP trong tầm soát HCC sẽ cho độ nhạy phát hiện HCC là 92% và độ đặc hiệu là 82%.
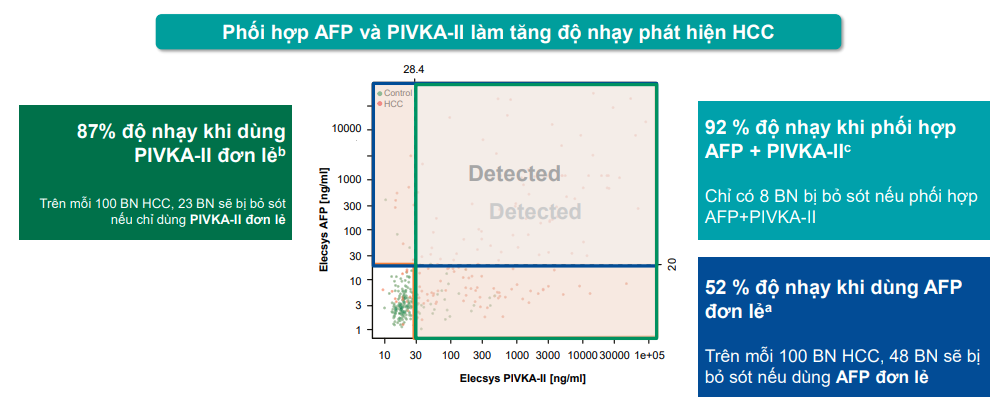
Hình 9. Hiệu năng phối hợp AFP và PIVKA II trong nghiên cứu của Henry Ly Chan và các cộng sự 2020.
2.1.4 Phối hợp AFP, PIVKA II, tuổi, giới trong giám sát HCC (GAAP)
Ngoài việc nghiên cứu các chỉ dấu nhằm đáp ứng phát hiện sớm ung thư biểu mô tế bào gan thì các tác giả cũng đang phối hợp các chỉ dấu này dựa trên thang điểm GAAP để cung cấp những giá trị trong chẩn đoán và theo dõi điều trị được tốt hơn. Tuổi cao và giới nam là những yếu tố nguy cơ quan trọng liên quan đến sự tiến triển thành UTBMTBG. GAAP là một công cụ để phát hiện UTBMTBG được phát triển bởi Liu M và các cộng sự bằng cách sử dụng một mô hình thống kê xác định nguy cơ UTBMTBG ở từng bệnh nhân mắc bệnh gan mạn tính. Thang điểm GAAP cho thấy hiệu quả phát hiện UTBMTBG cao hơn so với việc sử dụng các chỉ số riêng lẻ. Thang điểm này có tiềm năng sử dụng để thể giảm thiểu một số những hạn chế của siêu âm, bao gồm giảm độ nhạy ở bệnh nhân béo phì và bệnh nhân xơ gan tiến triển. Điều đó rất quan trọng cho việc tầm soát vì bệnh phát hiện càng sớm thì cơ hội điều trị khỏi càng cao.
GAAP = −11.203 + 0.699 × (giới tính nam = 1 và giới tính nữ = 0) + 0.094 × Tuổi + 1.076 × log10 [AFP] + 2.376 × log10 [DCP]
Theo Hemken PM và các cộng sự thì thang điểm GAAP khả năng tầm soát HCC có độ nhạy 93% và độ đặc hiệu 84%, trong một nghiên cứu công bố vào năm 2019.
Ngoài thang điểm GAAP, các nhà nghiên cứu cũng xây dựng và phát triển các thang điểm khác với những thuật toán khác nhau như: GALAD , GALADUS, GALAD-C… Các thang điểm này sử dụng thông số tương tự như thang điểm GAAD nhưng khác công thức tính toán và có kết hợp thêm yếu tố nào khác.
3.Kết luận
Ung thư biểu mô tế bào gan (HCC) là một trong những loại ung thư khó điều trị và tiên lượng xấu nếu phát hiện trễ. Chẩn đoán sớm và chính xác ung thư biểu mô tế bào gan giúp giảm gánh nặng điều trị và tăng thời gian sống cho bệnh nhân.
Với nhiều công trình nghiên cứu hiện nay, các dấu ấn chỉ điểm ung thư AFP, AFP-L3, DCP đã khẳng định vai trò quan trọng trong việc tầm soát phát hiện sớm ung thư biểu mô tế bào gan. Ngoài các dấu ấn trên, các nhà nghiên cứu đã tìm thấy các dấu ấn khác: AKR1B10, AXL, Thioredoxin, Các DNA khối u vòng… đang trong giai đoạn thử nghiệm và chứng minh khả năng phát hiện sớm HCC.
Các thang điểm như GAAP, GALAS, GALADUS… cung cấp những giá trị chẩn đoán sớm và chính xác hơn so với việc sử dụng các dấu ấu riêng biệt. Nhiệm vụ của các thầy thuốc phải biết tận dụng uyển chuyển, linh hoạt những phương tiện những phương tiện chẩn đoán trong tay để phát hiện và điều trị sớm HCC.
TÀI LIỆU THAM KHẢO
- Bộ Y tế, Quyết định số 3129/QĐ-BYT ban hành ngày17 tháng 7 năm 2020 về Hướng dẫn chẩn đoán và điều trị ung thư biểu mô tế bào gan.
- TS.BS. Nguyễn Thị Băng Sương, Giá trị và Hiệu năng của các phối hợp dấu ấn ung thư, Hội nghị Hóa sinh 2022, trang 94-117.
- TS.BS. Phạm Thị Thu Thủy, Các chỉ dấu sinh hóa hiện tại và mới liên quan ung thư biểu mô tế bào gan (hcc), trang 1-9.
- Trần Thị Thu Thảo, Nghiên cứu giá trị các xét nghiệm alpha-fetoprotein (afp), afp-l3% và des-gamma carboxyprothrombin (dcp) trong chẩn đoán bệnh ung thư biểu mô tế bào gan năm 2023, trang 1-37.
- Sung H, Ferlay J, Siegel RL, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA: a cancer journal for clinicians. 2021;71(3):209-249.
- Clinical value of tumor markers- Rafael Molina, Xavier Filella, J. M. Augé, J. M. Escudero
- Cells2020, 9(6), 1370; https://doi.org/10.3390/cells9061370
- Takako Inoue et al (2020). Novel biomarkers for the management of chronic hepatitis B. Clinical and Molecular Hepatology – 26:261-279,2020.
- Tiong Sun China et al (2019). Molecular diagnosis of hepatocellular carcinoma : trends in biomarkers combination to enhance early cancer detection. Hepatoma Res; 5:9. Pp1-14.
- Chan HLY, Vogel A, Toni END, Kudo M et a, The Liver Meeting Digital Experience 2020, American Association of the Study of Liver Diseases 13-16 November 2020.
- Ricco G, et al. Cancer Biomark 2018; 21(3): 603-612.
- Hemken PM et al. Validation of a novel model for the early detection of hepatocellular carcinoma. Clin Proteom 2019;16:2